Tabelul periodic este construit astfel încât să reflecte structura internă a atomilor, în special distribuția electronilor în jurul nucleului. Elementele sunt aranjate în funcție de numărul atomic (numărul de protoni din nucleu), ceea ce determină și poziția lor în tabel.
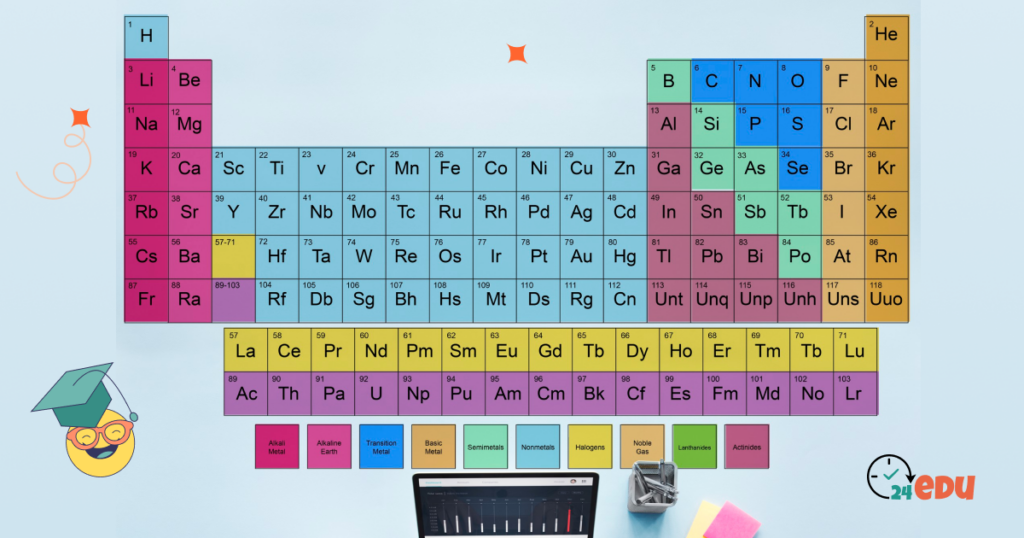
Conform Chemicool, scopul principal al tabelului periodic este de a evidenția tiparele de comportament chimic între elemente. De exemplu, elementele din aceeași coloană verticală (numite grupe) au proprietăți chimice similare, în timp ce cele din rânduri orizontale (perioade) prezintă o variație treptată a acestor proprietăți.
Tabelul nu este doar un instrument teoretic. Este folosit zilnic de chimiști, fizicieni, biologi, ingineri și profesori pentru a analiza reacții, a descoperi materiale noi și a înțelege mai bine lumea la nivel atomic.
Această structură elegantă și logică a fost posibilă datorită observațiilor făcute de-a lungul timpului, culminând cu propunerea tabelului de către chimistul rus Dmitri Mendeleev, care a lăsat chiar spații goale pentru elementele ce urmau să fie descoperite.
Istoria și evoluția tabelului periodic
Ideea de a clasifica elementele chimice a apărut odată cu dezvoltarea chimiei ca știință, în secolul al XVIII-lea. Pe măsură ce erau descoperite tot mai multe elemente, oamenii de știință au simțit nevoia unui sistem logic pentru a le organiza și a evidenția tiparele dintre ele.
Primele încercări de clasificare
- În 1789, chimistul francez Antoine Lavoisier a publicat o listă cu 33 de „substanțe simple”, pe care le-a clasificat în funcție de proprietăți precum metale, nemetale și gaze. Era un pas important, dar încă departe de un sistem periodic.
- În 1829, chimistul german Johann Wolfgang Döbereiner a observat că anumite grupuri de trei elemente (triade), precum calciu, stronțiu și bariu, prezentau proprietăți chimice similare și o relație matematică între masele lor atomice. Acesta a fost unul dintre primele semne ale unui model periodic.
Către o organizare coerentă
În 1864, englezul John Newlands a formulat „Legea octavelor”, observând că proprietățile elementelor se repetă la fiecare al optulea element, similar notelor muzicale. Deși ideea sa a fost inițial ridiculizată, a anticipat ideea de periodicitate.
Mendeleev și nașterea tabelului periodic modern
Dmitri Mendeleev, chimist rus, a fost cel care, în 1869, a publicat prima versiune a unui tabel periodic coerent, organizând elementele cunoscute după masa lor atomică și proprietățile chimice. El a lăsat spații goale pentru elementele care nu fuseseră încă descoperite, dar a prezis corect proprietățile acestora – o demonstrație remarcabilă de intuiție științifică.
Un exemplu celebru este predicția lui despre eka-siliciu, care a fost descoperit ulterior și denumit germaniu, având proprietățile exact cum le anticipase Mendeleev.
Corectarea după numărul atomic
- În secolul XX, odată cu dezvoltarea fizicii atomice, s-a înțeles că numărul atomic (nu masa atomică) este criteriul fundamental de organizare. Această corecție a fost susținută de cercetările fizicianului Henry Moseley în 1913, care a arătat că fiecare element are un număr unic de protoni în nucleu.
- Astfel, versiunea modernă a tabelului se bazează pe numărul atomic și nu pe masa atomică, oferind o explicație mult mai coerentă a periodicității.
Tabelul în epoca modernă
- În prezent, tabelul periodic include 118 elemente, dintre care unele au fost create artificial în laboratoare (precum oganesson, elementul 118).
- IUPAC (Uniunea Internațională de Chimie Pură și Aplicată) este organismul care standardizează tabelul, numele elementelor și simbolurile acestora.
- Tabelul a evoluat de-a lungul timpului în mai multe formate grafice, inclusiv modele circulare, spiralate sau în formă de scări, dar versiunea rectangulară rămâne cea mai utilizată în educație și cercetare.
Structura tabelului periodic
Tabelul periodic este construit într-un mod logic și ordonat, reflectând structura internă a atomilor și modul în care electronii sunt distribuiți în straturile energetice. Fiecare poziție a unui element în tabel este importantă și ne spune ceva important despre comportamentul său chimic.
Perioade și grupe
- Perioadele sunt rândurile orizontale ale tabelului. Sunt în total 7 perioade, care corespund numărului de straturi electronice ocupate într-un atom.
- Exemplu: hidrogenul și heliul se află în perioada 1 (au un singur strat electronic), iar uraniul se află în perioada 7 (șapte straturi).
- Pe măsură ce ne deplasăm de la stânga la dreapta într-o perioadă, numărul atomic crește, iar proprietățile chimice se modifică progresiv.
- Grupele sunt coloanele verticale. Există 18 grupe principale, numerotate de la 1 la 18 (sau, în sistemul vechi, cu cifre romane și litere: IA, IIA etc.).
- Elementele din aceeași grupă au același număr de electroni de valență (electroni din stratul exterior), ceea ce le conferă proprietăți chimice similare.
- Exemplu: toți membrii grupei 1 (metalele alcaline) sunt foarte reactivi cu apa și formează hidroxizi.
Blocuri: s, p, d, f
Tabelul periodic este împărțit și în funcție de tipul orbitalului atomic în care se află electronul de valență al fiecărui element. Astfel apar patru blocuri electronice:
- Blocul s
- Cuprinde grupele 1 și 2, plus hidrogenul și heliul.
- Elementele din acest bloc au electronii de valență în orbitalul s.
- Sunt în general metale reactive (ex: litiu, sodiu, calciu).
- Blocul p
- Include grupele 13-18.
- Electronii de valență se află în orbitalul p.
- Cuprinde o varietate de elemente: metale, nemetale, gaze nobile.
- Blocul d
- Reprezintă elementele de tranziție (grupele 3-12).
- Electronii activi se află în orbitalul d.
- Aceste elemente au frecvent mai multe stări de oxidare și formează compuși colorați (ex: fier, cupru, zinc).
- Blocul f
- Include lantanoidele și actinoidele, situate sub tabelul principal.
- Electronii de valență sunt în orbitalul f.
- Multe dintre aceste elemente sunt radioactive și au aplicații tehnologice speciale.
Metale, nemetale și metaloizi
- Metalele
- Reprezintă majoritatea elementelor din tabel.
- Sunt în general bune conductoare de electricitate și căldură, maleabile și strălucitoare.
- Se găsesc în partea stângă și centrală a tabelului.
- Exemple: fier, aluminiu, aur.
- Nemetalele
- Se află în partea dreaptă a tabelului.
- Au proprietăți opuse metalelor: sunt slabe conducătoare, casante, fără luciu metalic.
- Joacă un rol cheie în biochimie și compuși organici (ex: oxigen, azot, carbon).
- Metaloizii
- Se află de-a lungul unei diagonale în zigzag între metale și nemetale (ex: bor, siliciu, arsen).
- Au proprietăți intermediare, fiind conductori semimetalici.
- Sunt importanți în industria electronică (siliciul este baza pentru semiconductori).
Utilizarea tabelului periodic
Tabelul periodic nu este doar o simplă schemă — este o unealtă extrem de practică în chimie și științele conexe. Prin înțelegerea structurii sale și a modului în care sunt afișate informațiile, putem deduce cu ușurință proprietățile elementelor și felul în care acestea reacționează între ele.
Cum se citesc informațiile despre un element
Fiecare celulă din tabelul periodic oferă date importante despre un element:
- Simbolul chimic – abrevierea formată din una sau două litere (ex: H pentru hidrogen, Fe pentru fier). Prima literă este întotdeauna majusculă, a doua (dacă există) este minusculă.
- Numărul atomic (Z) – este poziționat de obicei în colțul din stânga sus și indică numărul de protoni din nucleul atomului. Într-un atom neutru, acesta este și numărul de electroni.
- Numele elementului – uneori este inclus sub simbol, pentru claritate (ex: „Oxygen”).
- Masa atomică relativă – afișată sub nume sau simbol, exprimată în unități atomice (u), reprezintă media ponderată a maselor izotopilor elementului.
- Configurația de valență (implicită din poziția în tabel) – poziția într-o anumită grupă și perioadă oferă indicii despre distribuția electronilor și comportamentul chimic.
Exemplu:
Pentru carbon (C):
- Număr atomic: 6
- Simbol: C
- Masă atomică: ~12,01 u
- Grupă: 14 → are 4 electroni de valență
- Perioadă: 2 → are 2 straturi electronice
Predicția proprietăților chimice și fizice
Tabelul periodic este conceput astfel încât să reflecte periodicitatea proprietăților elementelor. Această organizare permite anticiparea comportamentului chimic, fără să fie necesară testarea practică a fiecărui element.
Cu ajutorul tabelului poți deduce:
- Reactivitatea chimică
- Metalele alcaline (grupa 1) sunt extrem de reactive, în special cu apa.
- Gaze nobile (grupa 18) sunt aproape inerte chimic.
- Tipul de legături chimice
- Nemetalele tind să formeze legături covalente între ele.
- Metalele cu nemetalele formează de obicei legături ionice.
- Tendințe periodice
- Raza atomică: scade de la stânga la dreapta într-o perioadă și crește de sus în jos într-o grupă.
- Electronegativitatea: crește spre dreapta și în sus (fluorul fiind cel mai electronegativ).
- Energie de ionizare: urmează același tipar ca electronegativitatea – mai mare la nemetale, mai mică la metale.
- Caracterul metalic: crește spre stânga și în jos.
Folosirea practică:
- Un chimist poate alege un reactiv pe baza poziției sale în tabel.
- Se pot estima produsele unei reacții chimice.
- Se poate anticipa stabilitatea unui compus, toxicitatea sau chiar aplicațiile industriale ale unui element.
Tabelul periodic modern și versiunile sale
Tabelul periodic modern reflectă în mod direct înțelegerea profundă a structurii atomice și a proprietăților elementelor chimice. Deși cea mai utilizată formă este cea dreptunghiulară, tabelul a cunoscut de-a lungul timpului și alte versiuni — fiecare cu scopuri specifice și avantaje vizuale sau funcționale.
Tabelul periodic modern (standard)
- Este forma rectangulară sau „lungă” a tabelului, recunoscută universal și folosită în majoritatea manualelor, laboratoarelor și instituțiilor de învățământ.
- Elementele sunt organizate în 18 grupe (coloane) și 7 perioade (rânduri), cu blocurile s, p, d și f clar separate.
- Lantanoidele și actinoidele sunt așezate într-un rând separat, sub tabelul principal, pentru a păstra lizibilitatea și proporțiile. În realitate, ele aparțin perioadelor 6 și 7, bloc f.
- Această formă este standardizată de către IUPAC, care a stabilit și numerotarea oficială a grupelor de la 1 la 18.
Versiuni alternative ale tabelului periodic
1. Tabelul periodic scurt (forma Mendeleev clasică)
- Are doar 8 grupe (IA – VIIIA) și poziționează blocul d într-o manieră compactă.
- Era folosit înainte ca structura electronică să fie înțeleasă complet.
2. Tabelul periodic lung complet (fără rânduri separate)
- Integrează lantanoidele și actinoidele direct în tabel, ceea ce îl face mai complet, dar mai greu de citit.
- Este apreciat în cercetare pentru a arăta continuitatea perioadelor.
3. Tabele spiralate
- Aranjează elementele în spirală în jurul nucleului, reprezentând mai clar periodicitatea naturală.
- Propus de mai mulți chimiști (ex: Benfey) ca o formă estetică și pedagogică.
4. Tabelul periodic 3D sau sferic
- Reprezintă tabelul ca o structură tridimensională, sugerând legătura dintre fizica cuantică și poziționarea elementelor.
- Deși spectaculoase, aceste modele sunt rareori folosite în practică.
5. Tabelul periodic cu coduri de culoare
- Utilizează culori pentru a indica stări de agregare, tipuri de elemente (metal, nemetal, metaloid) sau niveluri de electronegativitate.
- Foarte frecvent în aplicații educaționale și materiale vizuale.
De ce există mai multe versiuni?
- Scopul fiecărei variante este să evidențieze un anumit aspect al chimiei: proprietăți electronice, istorie, aplicații sau tendințe vizuale.
- Unele sunt mai potrivite pentru predare, altele pentru cercetare sau vizualizare artistică.
- Totuși, indiferent de formă, relațiile fundamentale dintre elemente rămân aceleași.
Importanța tabelului în educație și știință
Tabelul periodic nu este doar un instrument fundamental pentru chimiști — el stă la baza întregii educații științifice și joacă un rol important în cercetare, industrie, medicină și tehnologie. Simplitatea sa aparentă ascunde o complexitate remarcabilă, fiind una dintre cele mai puternice sinteze de informație științifică create vreodată.
În educație
- Este una dintre primele noțiuni predate în chimie încă din gimnaziu, deoarece oferă un cadru clar pentru a învăța proprietățile elementelor și legile reacțiilor chimice.
- Ajută elevii să înțeleagă periodicitatea proprietăților – în loc să memoreze elemente izolate, aceștia învață să observe modele și tendințe.
- Facilitează legătura între chimie, fizică și biologie – de exemplu, explică de ce atomii formează anumite tipuri de legături sau cum funcționează fotosinteza și respirația celulară la nivel atomic.
- Dezvoltă gândirea logică și predictivă – elevii învață să deducă reacții chimice, stări de oxidare, comportamente fizice, fără a le învăța pe de rost.
În știință și cercetare
- Este important în descoperirea și clasificarea de noi elemente – cercetătorii care lucrează cu elemente sintetice (super-grele) folosesc tabelul pentru a anticipa proprietăți înainte de a le produce în laborator.
- Permite dezvoltarea de materiale noi – aliaje, semiconductori, compuși speciali (ex: superconductori, catalizatori industriali) sunt studiați și proiectați pe baza poziției în tabel.
- Conectează chimia cu fizica atomică și teoria cuantică – fiecare poziție în tabel este legată direct de configurația electronică și de interacțiunile fundamentale ale particulelor.
- Este folosit în domenii interdisciplinare precum:
- biochimie (interacțiunea ionilor metalici cu enzimele)
- medicină (elemente utilizate în tratamente – litiu, iod, radiu)
- inginerie (selecția materialelor în funcție de rezistență, conductivitate etc.)
Un limbaj universal
- Tabelul periodic este în același timp un limbaj comun între oameni de știință din întreaga lume, indiferent de limbă sau sistem educațional.
- Este un exemplu rar de model științific care combină eleganța matematică cu utilitatea practică, fiind atât un simbol cultural, cât și o unealtă indispensabilă.
Curiozități despre elemente și descoperiri recente
Curiozități despre elemente
- Hidrogenul este cel mai ușor și mai abundent element din univers, alcătuind aproximativ 75% din masa sa. Este și primul apărut după Big Bang.
- Heliul a fost descoperit mai întâi în Soare, nu pe Pământ. Astronomii au identificat o linie spectrală necunoscută în 1868 și au numit elementul „helium”, după cuvântul grecesc helios (soare).
- Galiul se topește în palmă. Are un punct de topire de doar 29,76 °C și era folosit în experimente demonstrative, unde o linguriță aparent solidă „dispare” în mâna celui care o ține.
- Aurul este unul dintre puținele metale care are o culoare diferită de gri sau argintiu. Strălucirea sa galbenă este rezultatul unor efecte relativiste la nivel atomic.
- Tungstenul are cel mai înalt punct de topire dintre toate elementele naturale – 3422 °C – și este folosit în filamentul becurilor sau în aplicații militare și aerospațiale.
- Oxigenul lichid este albastru deschis și este magnetic. Poate fi deviat de un câmp magnetic puternic, lucru rar întâlnit la substanțe lichide.
- Carbonul are mai multe forme cristaline uimitor de diferite, de la grafit (moale și negru) la diamant (ultra-dur și transparent) – ambele formate doar din atomi de carbon.
Descoperiri recente în tabelul periodic
- Elementele super-grele precum nihoniu (113), moscoviu (115), tenesin (117) și oganesson (118) au fost confirmate oficial între 2004 și 2016. Acestea au fost sintetizate în laboratoare de cercetare avansată (în Japonia, Rusia și SUA).
- Oganesson (Og) este cel mai greu element creat până acum și ar putea avea proprietăți complet diferite față de cele ale gazelor nobile din aceeași grupă. Teoriile sugerează că ar putea fi semimetalic sau chiar reactiv.
- Căutarea „insulei de stabilitate” – o ipoteză conform căreia unele elemente super-grele ar putea avea nuclee mai stabile decât cele descoperite până acum. Dacă ar fi creat, aceste elemente ar putea avea timp de viață suficient de mare pentru a fi studiate detaliat sau chiar utilizate.
- Materiale noi pe bază de elemente cunoscute sunt descoperite constant:
- grafenul, derivat din carbon, este un material bidimensional extrem de rezistent și conductor.
- perovskitele, folosite în panouri solare, conțin elemente precum plumb și halogeni.
- Explorarea spațială aduce provocări noi pentru tabelul periodic – există cercetări asupra reacțiilor chimice în gravitație zero și asupra comportamentului elementelor în condiții extreme.
Tabelul periodic nu este un sistem închis — este în continuă extindere și reinterpretare. Fiecare nou element sau descoperire ne apropie de o înțelegere mai profundă a materiei și a legilor care guvernează universul.

Leave a Reply